Soru Sor
Sorunu sor hemen cevaplansın.
Kovalent Bağ (Özet) : Atomlar arasında, son katmanlarda yer alan elektronlardan bazılarının ortaklaşa kullanılmasıyla oluşan bağa Kovalent Bağ denir. Kovalent bağ, iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır.
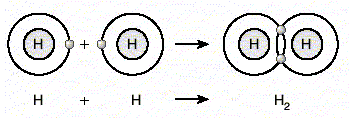
Kovalent Bağ (Detay) : Ametal atomları kararlı yapıya ulaşmak için son yörüngedeki bazı elektronlarını ortaklaşa kullanırlar. Atomlar arasında elektronların ortaklaşa kullanılmasıyla oluşan bağa kovalent bağ denir. Örneğin iki hidrojen atomu elektronlarını ortaklaşa kullanarak aralarında kovalent bağ oluşturur. Böylece her bir hidrojen atomu helyumun kararlı yapısına ulaşır.
Hidrojen gibi birçok ametal başka ametallerle bileşik oluştururlar. CO, H2O, NO2, CO2 bunlardan bazılarıdır.
Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir. Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Su molekülünün bağ yapısı bir su molekülü iki hidrojen ve bir oksijen atomunun kovalent bağ yapması sonucu oluşur. Hidrojen atomlarından her biri kendi elektronunu oksijen atomunun bir elektronu ile ortaklaşa kullanır. Böylece hidrojen atomları kararlı helyuma benzerken, oksijen atomu da kararlı neona benzer.
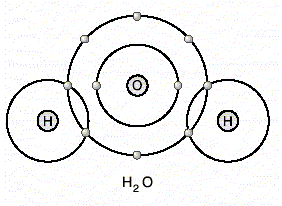
Bir su molekülü 2 hidrojen ve 1 oksijen atomundan oluştuğu için, su molekülü H2O şeklinde yazılır.
Kovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Tarih: 2016-03-02 01:56:53 Kategori: Sözlük
Soru Tarat
Kitaptan sorunu tarat hemen cevaplansın.
Sorunu sor hemen cevaplansın.
Kovalent Bağ Nedir
Kovalent Bağ (Detay) : Ametal atomları kararlı yapıya ulaşmak için son yörüngedeki bazı elektronlarını ortaklaşa kullanırlar. Atomlar arasında elektronların ortaklaşa kullanılmasıyla oluşan bağa kovalent bağ denir. Örneğin iki hidrojen atomu elektronlarını ortaklaşa kullanarak aralarında kovalent bağ oluşturur. Böylece her bir hidrojen atomu helyumun kararlı yapısına ulaşır.

Hidrojen gibi birçok ametal başka ametallerle bileşik oluştururlar. CO, H2O, NO2, CO2 bunlardan bazılarıdır.
Kovalent bağ kuran atomlar arasında ortaklaşa kullanılan elektronlar, her iki atomu da dublet ya da oktete ulaştırır. Her iki atoma da iyon diyemeyiz. Çünkü elektron almamış, vermemişlerdir. Kovalent bağ aynı cins atomlar arasında oluyorsa apolar kovalent bağ adını alır.
Kovalent bağ farklı cins atomlar arasında oluyorsa polar kovalent bağ adını alır. Su molekülünün bağ yapısı bir su molekülü iki hidrojen ve bir oksijen atomunun kovalent bağ yapması sonucu oluşur. Hidrojen atomlarından her biri kendi elektronunu oksijen atomunun bir elektronu ile ortaklaşa kullanır. Böylece hidrojen atomları kararlı helyuma benzerken, oksijen atomu da kararlı neona benzer.

Bir su molekülü 2 hidrojen ve 1 oksijen atomundan oluştuğu için, su molekülü H2O şeklinde yazılır.
Kovalent bağlı yapılar molekül oluşturur. Atomlar arasında elektron ortaklaşması veya elektron alışverişi olmazsa kimyasal bağ da olmaz.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Tarih: 2016-03-02 01:56:53 Kategori: Sözlük
Kitaptan sorunu tarat hemen cevaplansın.
Yorum Yapx

 8 yıl önce
8 yıl önce